28 Oct LA FDA DESIGNA MEDICAMENTO HUÉRFANO PARA EL TRATAMIENTO DE GLIOMA AL FÁRMACO LAM561, DESARROLLADO POR LA BIOTECNOLÓGICA ESPAÑOLA LAMINAR PHARMACEUTICALS
Según el Plan de Desarrollo Clínico de Laminar Pharma la aprobación de comercialización y uso en práctica clínica se espera sea otorgada para 2023.
Nota de prensa, Palma de Mallorca, 28 de octubre 2021
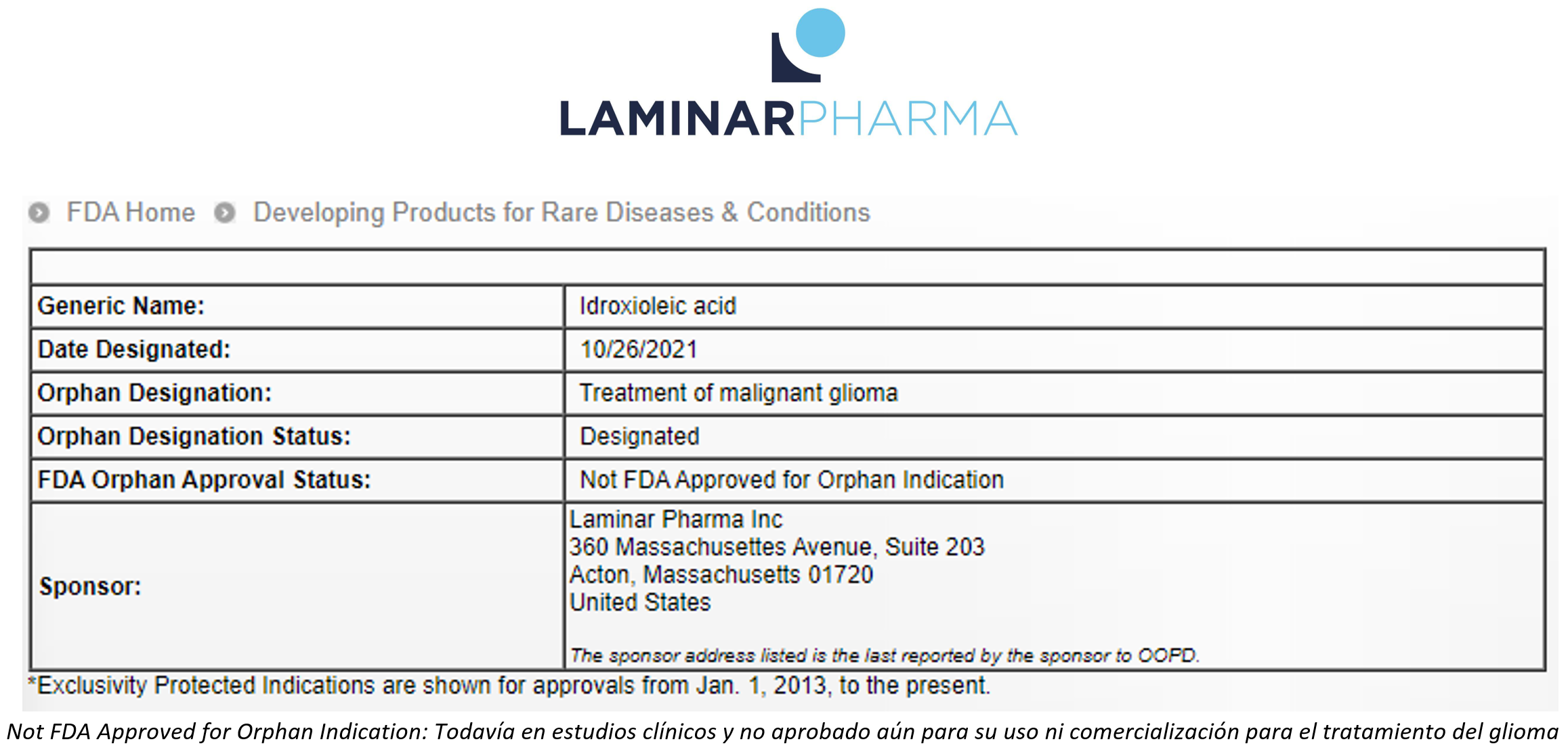
La Agencia Estadounidense del Medicamento (Food and Drug Administration, FDA) ha designado el LAM561, fármaco de la empresa Laminar Pharmaceuticals S.A., medicamento huérfano para el tratamiento de gliomas (https://www.accessdata.fda.gov/scripts/opdlisting/oopd/detailedIndex.cfm?cfgridkey=844021). El glioma es un tipo de tumor cerebral agresivo para el que hay grandes necesidades terapéuticas ya que no existe un tratamiento efectivo y mantiene una elevada mortalidad pocos meses después del diagnóstico.
La designación de medicamento huérfano reconoce el potencial beneficio del LAM561 para el tratamiento de esta enfermedad, ya que dicho proceso evalúa el balance entre beneficio terapéutico y el riesgo asociado a cualquier tratamiento. El LAM561 ya ha finalizado dos estudios clínicos en pacientes con cáncer (fases 1 y 2), en los que ha mostrado su seguridad e indicado actividad terapéutica. En la actualidad, el LAM561 se está evaluando en dos estudios, un ensayo de seguridad en niños en EEUU, y se está completando el último ensayo clínico internacional para demostrar su eficacia en el tratamiento de glioblastomas (gliomas) en pacientes adultos. De acuerdo al Plan de Desarrollo Clínico de Laminar Pharma y se espera que la aprobación para comercialización y uso en práctica clínica se otorgue en unos dos años
La designación de un medicamento huérfano es un proceso para facilitar la autorización de fármacos que muestran un beneficio claro en enfermedades raras (con baja prevalencia), graves, y sin tratamiento actual efectivo. Por tanto, la FDA reconoce que los resultados obtenidos en estudios pre-clínicos y en humanos son suficientes para considerar LAM561 como un medicamento de potencial beneficio en la supervivencia de pacientes con glioma, pendiente de la finalización de los ensayos clínicos en marcha. Se puede seguir la evolución de los estudios clínicos del LAM561 en la página web oficial del NIH (del inglés, Institutos Nacionales de la Salud) del gobierno de EE.UU. a través de la página web ClinicalTrials.gov:
https://clinicaltrials.gov/ct2/results?cond=&term=hydroxyoleic+acid&cntry=&state=&city=&dist=
Este reconocimiento otorga al LAM561 una serie de beneficios para facilitar su desarrollo y posible aprobación para su comercialización en EE.UU., como el asesoramiento gratuito y la eliminación de tasas de aprobación.
Con esta designación de medicamento huérfano, Laminar encuentra un apoyo muy valioso para el desarrollo y aprobación de un medicamento que puede suponer un punto de inflexión en el tratamiento del cáncer, dada la ausencia de los graves efectos adversos que usualmente acompañan a la quimioterapia del cáncer.
Acerca de Laminar Pharmaceuticals Laminar es una empresa biofarmacéutica española comprometida con el desarrollo de terapias frente a enfermedades raras, como el glioma/glioblastoma, y enfermedades pediátricas. Por ello, la empresa también ha invertido más de 1 millón de € en la investigación de la eficacia del LAM561 frente al desarrollo de tumores en niños. Este estudio clínico pediátrico está apoyado financieramente por la prestigiosa Fundación americana Dana-Farber, que tiene como foco principal de sus actividades el cáncer infantil. La empresa tiene abierta en la actualidad una ampliación de capital hasta el 2 de noviembre de 2021, a la que se puede acceder contactando a través del correo info@laminarpharma.com y también https://www.fellowfunders.es/proyecto/Laminar2021. Este crowdfunding constituye un mecanismo de inversión por el que se pueden adquirir acciones de la empresa. En la actualidad, ya se ha obtenido más de 1 millón de euros para afrontar el coste de los estudios clínicos que se llevan a cabo en varios países.
Para más información:
Irene Tato
Directora de Comunicación
Móvil: 657832016
i.tato@laminarpharma.com

